Impacts sanitaires et environnementaux d’un usage irraisonné des biocides Dr Philippe Carenco, Médecin hygiéniste
Les désinfectants et les antiseptiques font partie des substances dites « biocides », identifiées par une Directive européenne de 1998, révisée en 2012. Conformément au Règlement relatif aux produits biocides (no 528/2012), les biocides répondent à la définition suivante : toute substance ou tout mélange, sous la forme dans laquelle il est livré à l’utilisateur, constitué d’une ou plusieurs substances actives, en contenant ou en générant, qui est destiné à détruire, repousser ou rendre inoffensifs les organismes nuisibles, à en prévenir l’action ou à les combattre de toute autre manière par une action autre qu’une simple action physique ou mécanique.
Les biocides comprennent désinfectants, antiseptiques, antibiotiques, antiparasitaires, pesticides, insecticides, raticides, tous produits largement utilisés tant en médecine humaine que vétérinaire, en industrie agroalimentaire, en horticulture et agriculture (produits phytosanitaires).
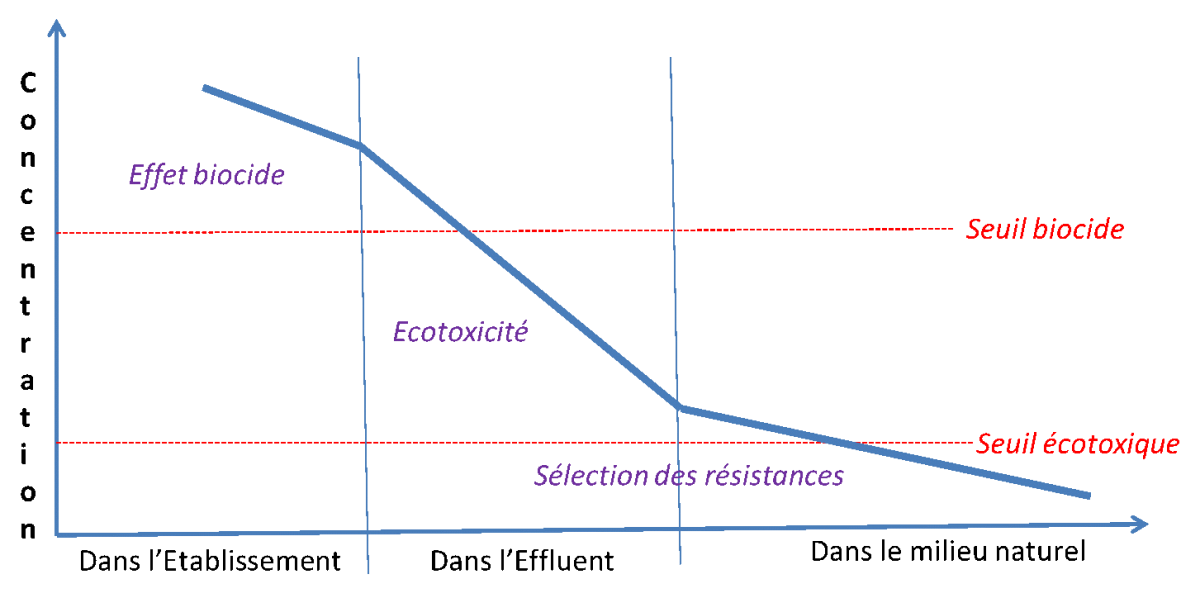
Ecotoxicité
Un effet toxique est la conjonction de la toxicité intrinsèque d’une substance vis-à-vis d’une espèce vivante dans des conditions de milieu déterminées et d’une exposition de cette espèce à la substance. Pour les produits chimiques tels que les détergents-désinfectants et les désinfectants, les tests de laboratoire les plus pertinents pour évaluer la toxicité aigüe du produit sont réalisés sur diverses espèces vivantes représentatives de différents compartiments du réseau trophique : bactéries, algues, daphnies et poissons.41
La principale empreinte sur la biodiversité des biocides est portée par l’écotoxicité de ces produits. L’impact sur la microflore et la microfaune en particulier dans les milieux aquatiques retentit sur l’ensemble des chaines trophiques. L’étude SIPIBEL illustre cet impact : la surveillance des effluents durant 4 ans, a montré que l’effluent hospitalier était nettement plus écotoxique que l’effluent urbain. 40
Acquisition des résistances aux biocides
Les résistances bactériennes découlent d’une adaptation à leur environnement afin d’assurer leur survie. Or, la réponse des bactéries aux biocides comporte de nombreux mécanismes communs à tous les mécanismes d’agression.
Ce processus d’acquisition de résistance par transfert d’information génétique. Ce transfert de gènes entre bactéries, souvent d’espèces différentes, se produit à partir d’un important stock de gènes de résistance (20 000 gènes), rapidement, entre des espèces bactériennes très différentes, à partir des différents microbiotes humain, animal ou environnemental (notamment les STEP), et au sein des biofilms constituant la forme d’organisation naturelle du monde bactérien en colonies multi-espèces communicantes.6, 7, 8 ,9
Les différentes échelles du transfert génétique
Les unités de transfert sont le plus souvent des éléments génétiques mobiles, c’est à dire des fragments de génome intégrés à des séquences de gènes capables de se connecter entre eux et au sein de plus grosses structures génétiques.12
Depuis le gène élémentaire sont ainsi assemblés des intégrons, des transposons, des plasmides, toutes structures transférables conférant à la bactérie réceptrice des propriétés qui lui permettront, le cas échéant, de survivre et de se reproduire au détriment des bactéries dépourvues de cet avantage sélectif. Au sein de ces séquences de gènes coexistent des gènes conférant une résistance aux désinfectants, d’autres plus spécifiquement aux antibiotiques, mais nombre de ces gènes agissent de concert sur plusieurs types de biocides, par un mécanisme d’action commun (comme les gènes induisant l’efflux du biocide hors de la bactérie)
Mais les bactéries elles-mêmes peuvent être transmises lors des contacts directs ou indirects entre individus. Les transmissions associées aux soins se situent dans ce cas de figure.
L’origine très ancienne de la résistance aux biocides
L’origine des résistances aux désinfectants se situe dans un très lointain passé, bien avant l’ère des antibiotiques, notamment la résistance au mercure.
Le potentiel d’oxydo-réduction du mercure peut varier, mais seul l’état oxydé est toxique. Par conséquent, les protéines qui détoxifient le mercure sont apparues il y a 2,5 milliards d’années lorsque la biosphère est devenue oxygénée 14. Les transposons de résistance au mercure ont été une caractéristique des bactéries résiduaires du sol pendant très longtemps15, 16. Or, on observe aujourd’hui que la résistance multiple aux antibiotiques est très fortement associée aux gènes de résistance au mercure, et que leurs gènes respectifs sont proches sur les transposons. Cette proximité entraîne leur expression conjointe.
La résistance au mercure a été facilitée par son exploitation minière et ses usages industriels et médicaux, avant même l’arrivée des antibiotiques. Or, les gènes de résistance aux antibiotiques ont commencé apparaître peu de temps après l’introduction clinique des antibiotiques17 et cette co-sélection conduit toujours la liaison croissante entre ces résistances. Ainsi, il existe un lien fort entre la résistance aux antibiotiques et la résistance au mercure.
De la même façon, il existe un lien étroit entre la multirésistance des bactéries gram négatives et la présence d’une famille de gènes qui confère la résistance aux ammoniums quaternaires et à la chlorhexidine, les deux composants les plus utilisés dans les désinfectants.
D’autre part, des bactéries conservées dans les sédiments gelés du grand Nord canadien, d’un âge estimé à 5000 ans contiennent des nucléotides similaires aux gènes de résistances aux antibiotiques modernes : la vie recycle ainsi ses méthodes de réponse au stress42.
L’accumulation progressive des gènes de résistance
Pour leur survie, les bactéries ne distinguent pas les antibiotiques des autres menaces : désinfectants, antiseptiques, car tous ces biocides induisent l’activation des gènes de résistance. On a montré récemment que la réponse des bactéries au stress (réponse SOS), qui peut être induite par une exposition aux antibiotiques, peut multiplier de 340 fois le phénomène d’excision et d’intégration de gènes de résistance.19
La résistance n’apparaît pas au moment de l’utilisation des biocides
L’efficacité quotidienne des biocides utilisés à l’hôpital et la pauvreté microbiologique de ses effluents montrent n’est pas le lieu adéquat pour l’adaptation des bactéries aux désinfectants : les concentrations utilisées y sont largement supérieures aux capacités de défense bactériennes26. S’il existe des cas publiés de résistance de certaines souches à des produits biocides concentrés, ils restent anecdotiques bien qu’éclairants sur les capacités d’adaptation des bactéries en milieu extrême.20
La plasticité génomique à l’origine des résistances aux biocides s’exprime dans le réseau d’assainissement puis dans l’environnement
La capacité à élaborer des mécanismes de défense peut être mise en œuvre en conditions favorables :
- temps de contact entre la bactérie et les biocides suffisant,
- concentration sublétaleen biocide
- au sein du réseau d’assainissement, où le biocide ne peut être épuré du fait de sa toxicité pour les bactéries épuratrices.
- Grâce aux pseudomonacées, qui du fait de leur plasticité et de leur rôle majeur dans la constitution du biofilm, permettent l’acquisition et la transmission des résistances au sein du réseau d’assainissement puis dans l’environnement via les boues des stations d’épuration.22
Impact des biocides de l’effluent hospitalier sur le réseau d’assainissement
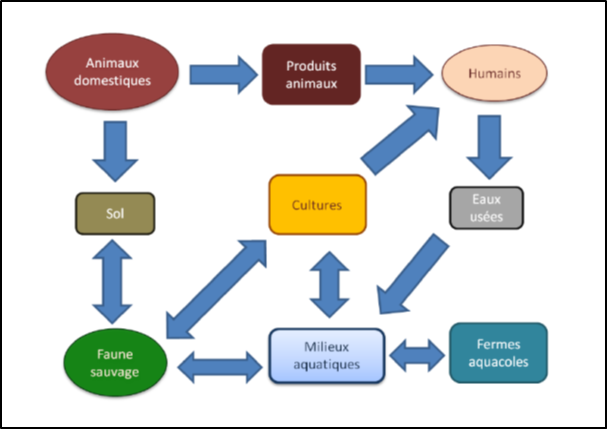
La diffusion des groupes de gènes de résistances à partir des effluents dans les milieux anthropisés et naturels a été étudiée.22 La concentration moyenne en gènes de résistances est équivalente dans les effluents issus des différentes activités humaines, qu’il s’agisse des hôpitaux, des maisons de retraite, des abattoirs, des stations d’épuration urbaines. Elle est plus faible dans les milieux aquatiques naturels (lacs, rivières).
Les effluents hospitaliers sont microbiologiquement très pauvres en raison des biocides (désinfectants et antibiotiques) qu’ils contiennent, ce qui peut d’ailleurs limiter les capacités épuratoires de l’effluent23. Par contre, les bactéries qu’ils contiennent sont nettement plus équipées en gènes de résistance qui leur permettent d’y survivre. Les hôpitaux contribuent ainsi à la diffusion et à la progression de l’antibiorésistance et de la résistance aux biocides.
Les espèces animales sauvages sont impliquées à leur tour
Des espèces animales sauvages ont acquis dans l’environnement (ou en lien avec une fréquentation des dépôts de déchets ou des eaux usées ?) des bactéries porteuses de gènes de résistance dans leur microbiote. Une étude chez les oiseaux de l’Arctique révèle 8,2% d’oiseaux porteurs de souches d’E. coli multi-résistantes, sans doute favorisées par les grandes migrations fréquentes chez ces espèces. 24 Les échanges entre les différents réservoirs de gènes de résistance ont été modélisés.
Les observations de co-résistance et de résistances croisées entre biocides et antibiotiques se multiplient
Ainsi, les biocides contribuent à des phénomènes d’antibiorésistance par le biais de mécanismes de co-résistance ou de résistance croisée.1,26 On parle de co-résistance lorsqu’au moins deux mécanismes de résistance sont portés par une même bactérie. La co-résistance peut provenir de l’acquisition d’une unité génétique qui contient plusieurs gènes de résistance. Le phénomène de résistance croisée correspond quant à lui à un seul mécanisme de résistance permettant de contrer plusieurs agents anti-bactériens. La résistance croisée peut provenir de l’expression d’une seule pompe à efflux qui peut exporter activement à la fois les ammoniums quaternaires et les antibiotiques. 26
Dans ce même cadre, une diminution de la sensibilité aux antibiotiques a été rapportée chez des souches bactériennes exposées à une dose subinhibitrice de biocides De même que l’exposition de bactéries aux biocides peut sélectionner des mutants résistants aux antibiotiques. 28
En dehors du contexte agro-alimentaire, la plupart des formulations à base d’ammonium quaternaire ne demande pas de rinçage à l’eau après leur application, ce qui implique que le temps de contact des bactéries avec ce type de biocides peut être prolongé. 29 Une longue période de contact avec un ammonium quaternaire doté d’une faible réactivité chimique peut exposer les bactéries à des concentrations subinhibitrices. Ceci favorise la survie de clones dont la susceptibilité aux composés antibactériens (biocides et antibiotiques compris) est diminuée. 30
D’autres auteurs rapportent des résultats analogues de résistance croisée avec le Triclosan, biocide très utilisé dans le domaine des produits d’hygiène personnelle et d’entretien domestique vendus comme « anti-bactériens » à grand renfort de marketing.32,33 Cet organo-chloré proche des chlorophénols est un puissant inducteur de résistances bactériennes aux antibiotiques, mais également un perturbateur endocrinien.33
Prise de conscience des experts scientifiques
Dès 2009, le SCENHIR (Scientific Committee on Emerging and NewlyIdentifiedHealth Risks) a été saisi par la Commission européenneen vue de l’Evaluation de l’effet des biocides sur la résistance bactérienne aux antibiotiques.34
Dans ses conclusions, on relève : « Il existe des preuves convaincantes que des mécanismes communs qui confère une résistance aux biocides et aux antibiotiques sont présents chez les bactéries et que les bactéries peuvent acquérir leur résistance grâce à l’intégration d’éléments génétiques mobiles. Ces éléments portent des gènes indépendants qui confèrent une résistance spécifique à la fois aux biocides et aux antibiotiques ».
Le groupe de travail spécial pour la préservation des antibiotiques a rendu son rapport1 et ses propositions en juin 2015, bases du plan national d’alerte sur les antibiotiques. L’essentiel porte sur la pratique de l’antibiothérapie humaine, mais on peut y lire : « Par ailleurs, il est important de ne pas restreindre les réflexions sur l’antibiorésistance uniquement à l’utilisation des antibiotiques. Notamment, l’utilisation immodérée des désinfectants et biocides, y compris par les particuliers, pourrait participer à la sélection croisée des résistances. »
Actions menées en PACA pour un usage raisonné des biocides en milieu de soins
En région PACA a été menée dans le cadre du PRSE une action de formation aux méthodes alternatives d’entretien des locaux auprés de 267 établissements entre 2009 et 2017, qui a permis de réduire de 45% la quantité de produits utilisés dans cette fonction43. Avec une consommation moyenne de 3,5 tonnes pour 100 lits/an, la quantité économisée se mesure à près de 1000 tonnes par an. Toutefois, l’absence d’organisation professionnelle dans l’entretien des locaux, l’absence de formation des acheteurs de ces produits et l’inconscience du risque chimique chez les utilisateurs restent les principaux défis à relever dans ce domaine d’activité.
Conclusion
Au même titre que les antibiotiques, l’usage des antiseptiques et des désinfectants doit être maitrisé en vue de préserver l’impact sur la biodiversité et préserver cette ressource naturelle indispensable : la sensibilité des écosystèmes microbiens aux biocides
Bibliographie
- http://invs.santepubliquefrance.fr/content/download/151349/551263/version/5/file/synthese_consommation_antibiotiques_resistance_antibiotiques_france_infection_evitee_antibiotique_preserve.pdf , consulté le 25/02/2019
- https://www.who.int/globalchange/ecosystems/biodiversity/fr, consulté le 25 février 2019
- O Wilson, F.M Peter. Biodiversity, national academypressWashingtion DC, 1988 : https://www.nap.edu/read/989/chapter/1
- Carlet J, Le Coz P. Tous ensemble, sauvons les antibiotiques–Propositions du groupe de travail spécial pour la préservation des antibiotiques. Ministère Aff Soc Santé Droits Femmes. 2015; http://social-sante.gouv.fr/IMG/pdf/rapport_antibiotiques.pdf, consulté le 2/06/2017
- The Independant, édition du 11 mars 2013.
- Des politiques publiques pour préserver l’efficacité des antibiotiques – Focus médicaments – Ministère des Affaires sociales et de la Santé [Internet]. [cité 2 déc 2016]. Disponible sur: http://social-sante.gouv.fr/soins-et-maladies/medicaments/focus-medicaments/article/des-politiques-publiques-pour-preserver-l-efficacite-des-antibiotiques
- Marshall BM, Levy SB. Food animals and antimicrobials : impacts on human health. Clin Mic R, 10-2011, 748-753
- Vega NM, Gore J. Collective antibiotic resistance: mechanisms and implications. oct 2014;21:28‑34.
- Sansonnetti P. Cours au collège de France, 9/12/2015
- Liu B, Pop M, ARDB–Antibiotic Resistance Genes Database Nucleic Acids Res. 2009 Jan;37(Database issue):D443-7.
- Gaze W, O’Neill C, Wellington E, Hawkey P. Antibiotic resistance in the environment, with particular reference to MRSA. 2008;63:249‑80.
- Singer AC, Shaw H, Rhodes V, Hart A. Review of Antimicrobial Resistance in the Environment and Its Relevance to Environmental Regulators. Front Microbiol [Internet]. 2016 [cité 6 déc 2016];7. Disponible sur: http://journal.frontiersin.org/article/10.3389/fmicb.2016.01728/abstract
- Kaplan HB, Greenberg « Diffusion of autoinducer is involved in regulation of the Vibrio fischeri luminescence system», J.of Bact., 163, 1erseptembre 1985, p. 1210–1214
- Rumbaugh KP, Griswold JA, Hamood AM. The role of quorum sensing in the in vivo virulence of Pseudomonas aeruginosa , Microbes and Infection / Institut Pasteur, 2, 1er novembre 2000, p. 1721–1731
- Stokes HW, Gillings MR. Gene£ow, mobile genetic elements and the recruitment of antibiotic resistance genes into Gram-negative pathogensFEMS Microbiol Rev 35 (2011) 790–819
- Foster TJ. The genetics and biochemistry of mercury resistance. Crit RevMicrobiol 15: 117–140.(1987)
- Barkay T, Kritee K, Boyd E, Geesey G. A thermophilic bacteria origin and subsequent constraints by redox, light and salinity on the evolution of the microbial mercuric reductase. Environ Microbiol 12: 2904–2917.(2010)
- Mindlin S, Kholodii G, Gorlenko Z et al. Mercury resistance transposons of gram-negative environmental bacteria and their classification. Res Microbiol 152: 811–822. . (2001)
- Mindlin S, Minakhin L, Petrova M, Kholodii G, Minakhina S, Gorlenko Z, Nikiforov V. Present-day mercury resistance transposons are common in bacteria preserved in permafrost grounds since the Upper Pleistocene. ResMicrobiol 156: 994–1004. (2005)
- Smith DH, R factors mediate resistance to mercury, nickel, and cobalt. Science 156: 1114–1116. (1967)
- Liebert CA, Ruth MH, Summers AO. Transposon Tn21, Flagship of the Floating Genome, Microbiol and Mol Biol Rev, 63, 3, 1092-2172/99/ Sept. 1999, p. 507–522
- Gaze WH, all. Impacts of anthropogenic activity on the ecology of class 1 integrons and integron-associated genes in the environment..The ISME Journal (2011) 5, 1253–126
- Harbarth S, Tuan Soh S. Is reduced susceptibility to disinfectants and antiseptics a risk in healthcare settings ?A point/counterpointreview. Hosp. Infec., 87 (2014), 194-202
- Marshall BM, Robleto E, Dumont T, Levy SB. The frequency of antibiotic-resistant bacteria in homes differing in their use of surface antibacterial agents. 2012 Oct; 65(4):407-15
- Stalder T. Implication des effluents d’activités hospitalières et de la filière carnée sur la dissémination de l’antibiorésistance : dynamique des intégrons de l’émission au rejet. Thèse Sci. Env., LIMOGES 2012
- Boillot C.Evaluation des risques écotoxicologiques liés aux rejets d’effluents hospitaliers dans les milieux aquatiques.Thèse INSA de Lyon, 2008.
- Sjolund M. Dissemination of Multidrug-Resistant Bacteria into the Arctic , Emerging Infect. , 14, No. 1, January 2008
- Vittecoq M, Renaud F. Quel rôle pour la faune sauvage dans la dynamique des antibiorésistances ? Colloque Santé-Biodiversité, 27-28 octobre 2014, VetAgro Sup, Marcy l’Etoile
- Ortega Morente E, Fernández-Fuentes MA, Grande Burgos MJ, Abriouel H, Pérez Pulido R, Gálvez A. Biocide tolerance in bacteria. Int J Food Microbiol. 1 mars 2013;162(1):13‑
- Meyer B, Cookson B. Does microbial resistance or adaptation to biocides create a hazard in infection prevention and control? J Hosp Infect. nov 2010;76(3):200‑5
- Webber MA, Whitehead RN, Mount M, Loman NJ, Pallen MJ, Piddock L.V. Parallel evolutionary pathways to antibiotic resistance selected by biocide exposure. J AntimicrobChemother. août 2015;70(8):2241‑
- Organization WH, others. Combating waterborne disease at the household level (2007). World Health Organ Glob Water Supply Sanit Assess. 2000;
- McBain AJ, Rickard AH, Gilbert P. Possible implications of biocide accumulation in the environment on the prevalence of bacterial antibiotic resistance. J IndMicrobiolBiotechnol. déc 2002;29(6):326‑
- Yu BJ, Kim JA, Ju HM, Choi S-K, Hwang SJ, Park S, et al. Genome-wide enrichment screening reveals multiple targets and resistance genes for triclosan in Escherichia coli. J Microbiol Seoul Korea. oct 2012;50(5):785‑
- Carey DE, McNamara PJ. The impact of triclosan on the spread of antibiotic resistance in the environment. Front Microbiol. 2014;5:780.
- Wikipdia, Triclosan. https://fr.wikipedia.org/wiki/Triclosan, consulté le 02/06/2017
- Assessment of the Antibiotic Resistance Effects of Biocides,2009, http://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/scenihr_o_021.pdf consulté le 02/06/2017).
- Carenco P, Giard M, Leroy MG, Guille des Buttes AC, Texier MF, Badrikian L, Arbogast MC, Armand N. État des lieux sur l’entretien des sols en établissements de santé et médicosociaux. Hygiènes 2016; 4: 217-223.
- Centers for Disease Control and Prevention. Guidelines for environmental infection control in health-care facilities: recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC). MMWR 2003;52(No RR-10). p 89 http://www.cdc.gov/hicpac/pdf/guidelines/eic_in_HCF_03.pdf .consulté le 2/06/2017.
- SIPIBEL, rapport 2001-2015 ,Effluents hospitaliers et stations d’épuration urbaines : caractérisation, risques et traitabilité,GRAIE,
http://www.graie.org/Sipibel/publications/sipibel-rapport-effluentshospitaliersmedicaments-oct16.pdf
- Guide pour le choix des désinfectants, SF2H 2015
- Perron GG, Whyte L, Turnbaugh PJ, Goordial J, Hanage WP, Dantas G, et al. (2015), Functional Characterization of Bacteria Isolated from Ancient Arctic Soil Exposes Diverse Resistance Mechanisms to Modern Antibiotics. PLoS ONE 10(3): e0069533. doi:10.1371/journal.pone.0069533
https://www.paca.ars.sante.fr/system/files/2017-06/pratiques-achats-responsables-ES-ESMS-BD.pdf
Nos dernières informations

Les brèves de l’ASEF – 20 mars 2025
Partenariat Maison de Santé, interdiction des PFAS, non au plastique dans les cantines ...
Aspartame : Un édulcorant controversé à interdire ?
Les dangers de l'aspartame pour notre santé ...